Aula
Aula 
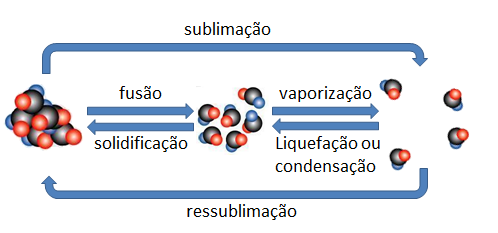
Aula 6-41: Calor sensível e calor latente

Quando se transfere calor a uma substância, elas podem se sevir deste calor para 1) elevar a sua temperatura ou 2) mudar de fase. O calor que é absorvido ou cedido pela substância e que faz com que ela varie de temperatura é chamado de calor sensível (Q1, Q3, Q5), enquanto que o calor responsável por fazer com que a substância se converta de um estado físico a outro estado é chamado de calor latente (Q2, Q4).
Observe o gráfico abaixo e observe a classificação do calor recebido pela substância em questão:
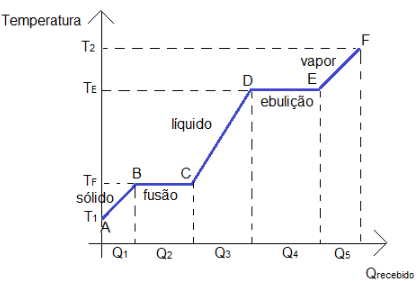 |
Q1: Calor sensível; |
Calor sensível
Correlacionadas ao calor sensível, existem duas gradezas físicas cujo entendimento é imprescindível para descrevermos o fenômeno físico aqui estudado:
➔ CAPACIDADE TÉRMICA (à pressão constante)
Capacidade térmica ou capacidade calorífica é a grandeza física que determina a relação entre a quantidade de calor fornecida ou retirada de um corpo e a variação de temperatura dele. Em outras palavras, podemos dizer que esta grandeza descreve a quantidade de calor necessária para impor uma variação a um corpo de uma unidade de temperatura.
Em aulas futuras, aprenderemos que podemos fazer variar a temperatura de uma substância conservando o sua pressão ou o seu volume. Neste caso, interessa-nos apenas variações à pressão constante.
⚛ A unidade de medida para a capacidade térmica, no SI. é o:
, no entanto, usa-se muito o:
Obs.: 1 caloria (cal) = 4,2 joules (J)
➔ CALOR ESPECÍFICO (à pressão constante)
Calor específico é uma grandeza física que indica a variação térmica de determinada substância ao receber determinada quantidade de calor. Também é chamado de capacidade térmica mássica. O calor específico é dado pela seguinte fórmula:
em que C é a capacidade térmica da substância e m massa da substância.
⚛ A unidade de medida para calor específico no SI é o:
no entanto, usa-se muito o
|
Substância |
C (cal/g.°C) |
|---|---|
|
Hélio |
1,25 |
|
Água |
1,00 |
|
Gelo |
0,55 |
|
Alumínio |
0,22 |
|
Areia |
0,20 |
|
Vidro |
0,16 |
|
Aço |
0,10 |
|
Ouro |
0,03 |
➔ EQUAÇÃO FUNDAMENTAL DA CALORIMETRIA
Se desenvolvermos a equação do calor específico, obteremos uma equação que nos fornece a quantidade de calor sensível em função da variação de temperatura operada em determinado corpo, tal equação é chamada equação fundamental da calorimetria:
VARIAÇÕES DE TEMPERATURA NO DESERTO
Como podemos observar na tabela acima, a água possui um elevado calor específico, em outras palavras, ela não varia de temperatura “facilmente”. Com efeito, as regiões do planeta terra que possuem água em abundância, seja no mar ou na atmosfera, se beneficiam desta propriedade e, portanto, têm a variação de temperatura amenizada devido a esta propriedade da água. No entanto, em lugares que carecem de água, a variação de temperatura não é amenizada; é, de fato, abrupta. Alguns bons exemplos destes lugares são os desertos, que possuem, muitas vezes, temperaturas elevadíssimas durante o dia e temperaturas negativas durante a noite.
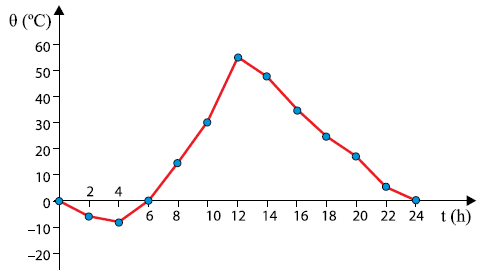 |
O gráfico ao lado representa, aproximadamente, como varia a temperatura ambiente no período de um dia, em determinada época do ano, no deserto do Saara. |
Calor latente
Este calor é a energia responsável pela conversão de massa de uma substância de um estado físico a outro. A fórmula que nos dá a quantidade de calor em função da quantidade de massa convertida é:
, em que
é o calor específico.
|
Substância |
Calor latente de fusão (cal/g) |
Calor latente de vaporização (cal/g) |
|---|---|---|
|
Água |
80 |
540 |
|
Álcool |
25 |
204 |
|
Alumínio |
95 |
2500 |
|
Mercúrio |
2,7 |
70 |
|
Chumbo |
6,8 |
200 |
|
Cobre |
65 |
1600 |