Aula
Aula 
Aula 6-43: Estados físicos da matéria

Fases (estados físicos da matéria)
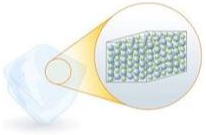
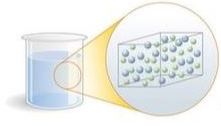
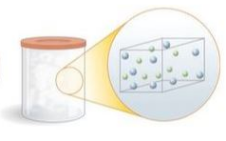
Por ora, estudaremos três estados físicos da matéria:
|
|
|
|
|
|
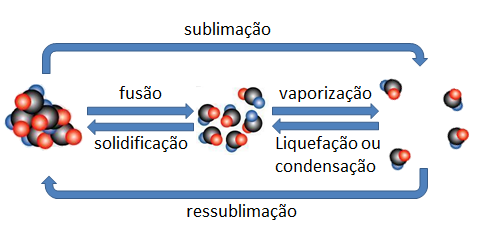
Processos de mudança de fases
|
Uma substância, ao receber ou ceder energia, poderá alterar a maneira com que os seus atomos se organizam para compô-la, ao acontecer isso, ela poderá ir de uma fasa a outra. A imagem ao lado fornece as nomenclaturas que distinguem os processos de troca |
|
VAPORIZAÇÃO: Uma substância pode ir de uma fase a outra de diferentes modos. O processo que conduz uma substância do estado liquido ao gasoso é genericamente chamado vaporização. Este processo pode ocorrer de pelo menos 3 modos distintos; a cada um destes modos damos um nome diferente:
◦ EVAPORAÇÃO: Processo em que o líquido se converte em gás espontaneamente, normalmente por influência do calor solar. Neste processo, a água se converte em gás mesmo em temperatura ambiente.
◦ EBULIÇÃO: Processo não espontâneo, forçado, em que submetemos o líquido elevadas quantidades de calor e ele se converte ao largo de um intervalo de tempo considerável (Ex.: Água fervendo na chaleira)
◦ CALEFAÇÃO: Neste processo, transfere-se muita energia para o líquido e muito rapidamente, Este processo de conversão é, pois, praticamente instantâneo.
LIQUEFAÇÃO OU CONDENSAÇÃO
◦ LIQUEFAÇÃO: Chamamos liquefação o processo que conduz um gás do estado gasoso ao estado líquido.
◦ CONDENSAÇÃO: Chamamos condensação o processo que conduz um vapor do estado gasos ao estado líquido.
Fatores que influenciam nos pontos de mudança de fase
Pelo menos dois fatores influenciam nos pontos de fusão e ebulição de determinada substância:
➔ PRESSÃO EXTERNA: Os pontos de fusão e ebulição variam de acordo com a pressão externa à substância analisada, pois quanto maior for a pressão agindo sobre a substância, maior será a quantidade de energia necessária para fazer com que um arranjo molecular se modifique.
➔ IMPUREZAS: As impurezas na substância podem modificar o arranjo molecular dela, fazendo com os pontos de fusão e ebulição variem.
Abaixo temos uma tabela que apresenta algumas substâncias, sem impurezas, e os seus respectivos pontos de mudanças de fase, na pressão de 1 atm.
|
Substância |
Ponto de fusão (°C) |
Ponto de ebulição (°C) |
|---|---|---|
|
Oxigênio |
- 218 |
- 183 |
|
Metano |
- 183 |
- 162 |
|
Água |
0 |
100 |
|
Alumínio |
660 |
2519 |
|
Prata |
692 |
2162 |
|
Ouro |
1064 |
2856 |
|
Ferro |
1568 |
2861 |
Sobrefusão
Sobrefusão é um estado físico metaestável (não estável) da matéria. Em algumas ocasiões, quando resfriamos um líquido a uma temperatura a baixo do seu ponto de fusão, sem submetê-lo a perturbações, pode acontecer de que o líquido permaneça líquido numa temperatura de fusão.
Para fazermos com que este líquido em sobrefusão se solidifique basca aplicarmos sobre ele uma perturbação.
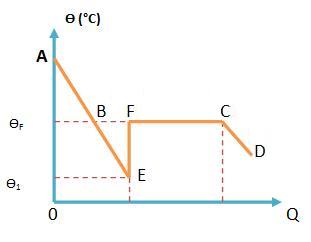
Diagrama de fases
Diagrama de fases é um gráfico que nos indica a fase de uma substância em função de sua temperatura e pressão. Cada substância possui, obviamente, um diagrama de fases diferente. Abaixo vemos o diagrama de fases da água:
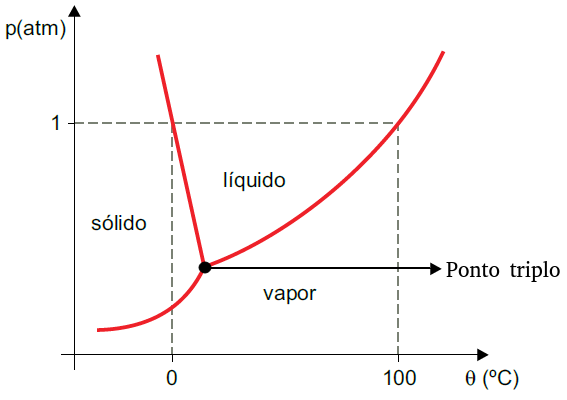
Obs.: O ponto triplo da água ocorre quando a submetemos a uma pessão de 0,0006 atm e a uma temperatura de 0,01 °C. Nestas condições, encontraremos água nos três estados físicos da matéria: água sólida, líquida e gasosa.