Aula
Aula 
Aula 6-45: Transformações gasosas e equação geral dos gases

Gases
➔ GÁS IDEAL: Sãos os gases que cumprem os requisitos listados abaixo:
◦ Composto de partículas puntiformes;
◦ As partículas colidem elasticamente entre si;
◦ Não há reação química entre as partículas.
➔ VARIÁVEIS DE ESTADO: São as grandezas físicas que variamos ao estudarmos o comportamento dos gases. São consideradas variáveis de estado a pressão, o volume e a temperatura.
|
PRESSÃO |
VOLUME |
TEMPERATURA |
|
Grandeza física que indica a concentração de força por unidade de área. |
Medida do espaço ocupado por um corpo. |
Medida do grau de agitação média das partículas que compõe determinado corpo. |
|
|
|
|
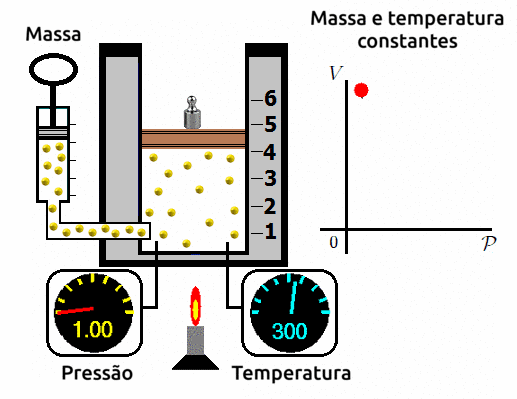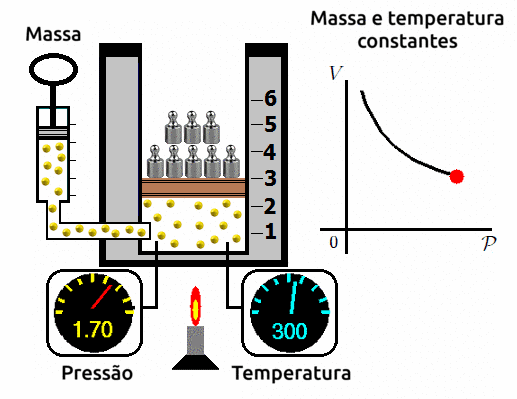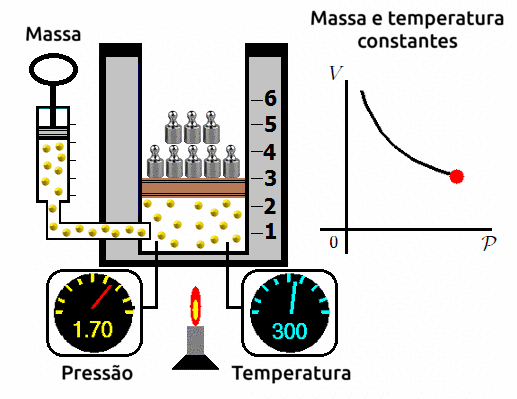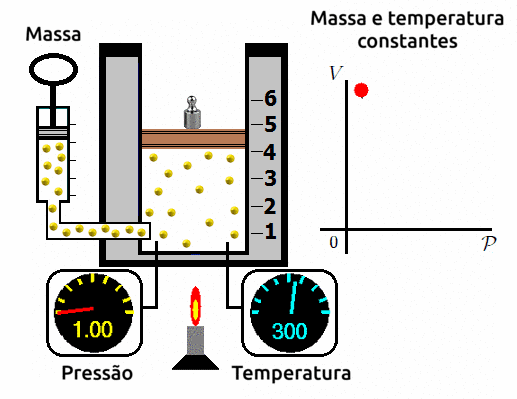
Transformações isotérmicas
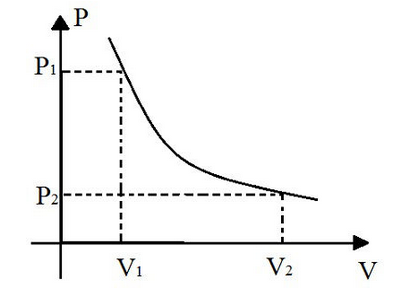
A transformação isotérmica é aquela em que submetemos o gás a uma temperatura constante e variamos o seu volume e a sua pressão. Ao se fazer este experimento, os cientistas observam que a variação de volume é inversamente proporcional a variação de pressão. Ou seja, quanto mais se aumentar o volume, mais reduzirá a pressão; e quando mais se reduzir o volume, mais se aumentará a pressão.
⚛ LEI DE BOYLE-MARIOTTE:
|
|
|
⚛ GRÁFICO PRESSÃO X VOLUME PARA TRANSFORMAÇÕES ISOTÉRMICAS
Transformações isocóricas/isovolumétricas/isométricas
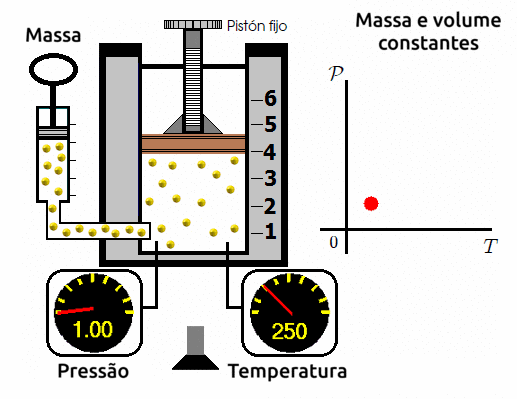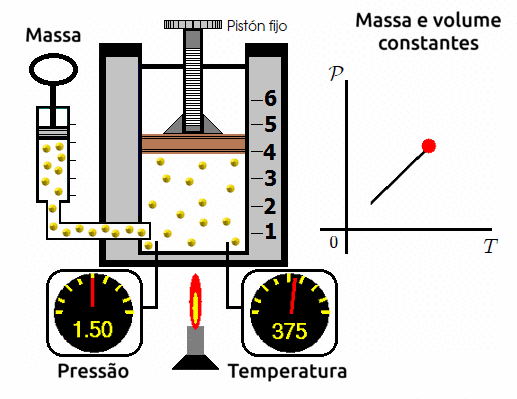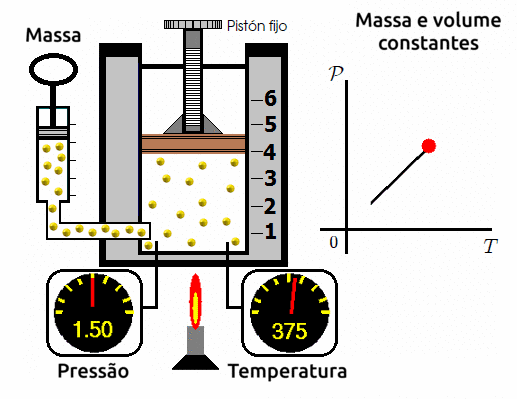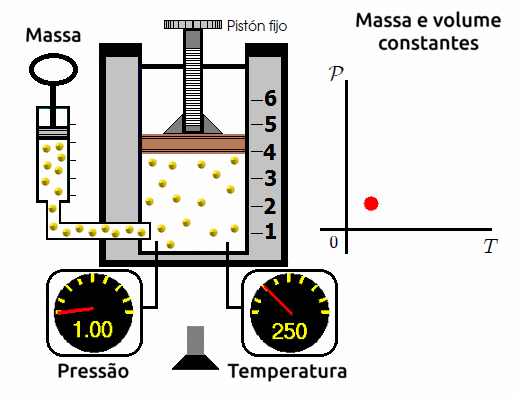
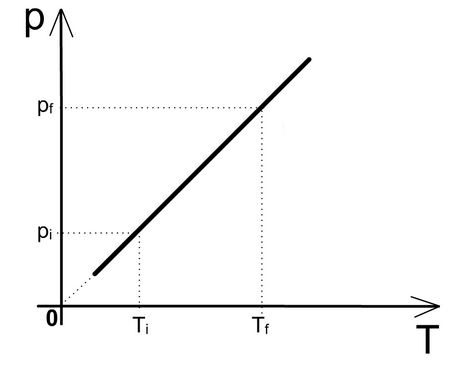
A transformação isovolumétrica é aquela em que submetemos o gás a um volume constante e variamos a sua temperatura e a sua pressão. Ao se fazer este experimento, os cientistas observam que a variação de temperatura é diretamente proporcional a variação de pressão. Ou seja, quanto mais se elevar a temperatura, mais se elevará a pressão; e quanto mais se reduzir a temperatura, mais se reduzirá a pressão.
⚛ LEI DE GAY-LUSSAC:
|
|
|
⚛ GRÁFICO PRESSÃO X TEMPERATURA PARA TRANSFORMAÇÕES ISOVOLUMÉTRICAS
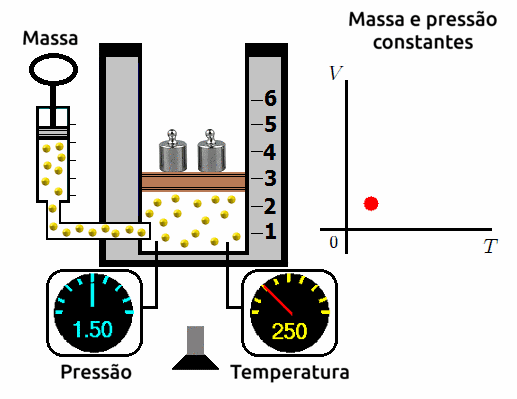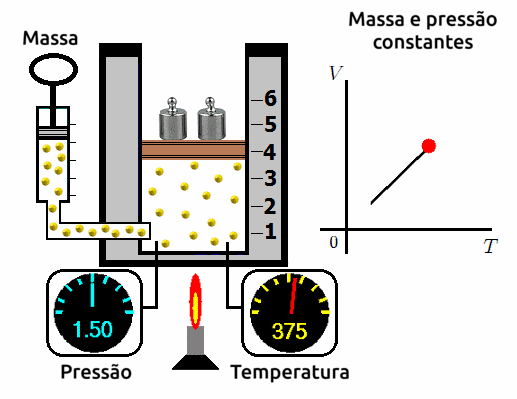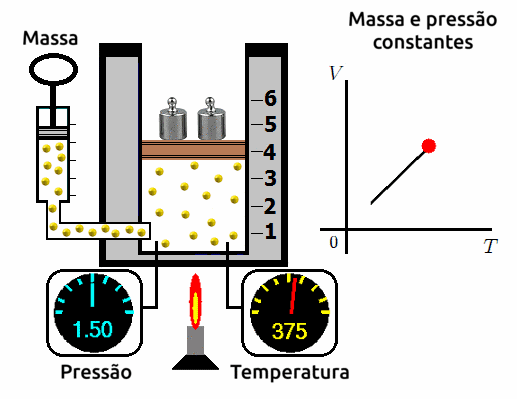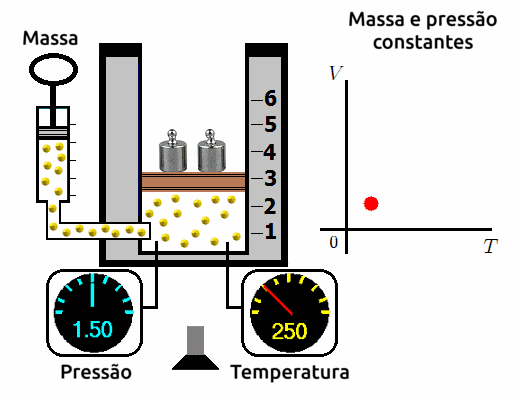
Transformações isobáricas
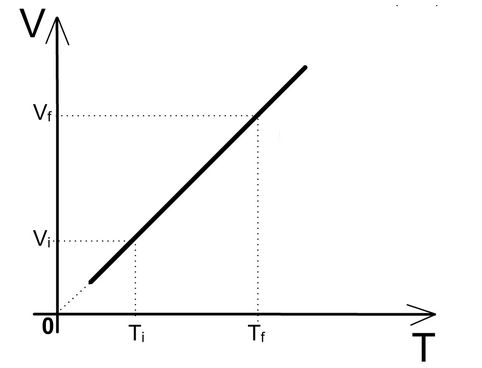
A transformação isobárica é aquela em que submetemos o gás a uma pressão constante e variamos o seu volume e a sua temperatura. Ao se fazer este experimento, os cientistas observam que a variação de volume é diretamente proporcional a variação de temperatura. Ou seja, quanto mais se aumentar o volume, mais aumentará a temperatura; e quanto mais mais se reduzir o volume, mais se reduzirá a temperatura.
⚛ LEI DE CHARLES:
|
|
|
⚛ GRÁFICO VOLUME X TEMPERATURA PARA TRANSFORMAÇÕES ISOBÁRICAS
Equação geral dos gases
É uma equação que abriga, de forma concisa, todas as informações apresentadas nas três leis mencionada acima:
Transformações adiabáticas
São as transformações em que a amostra gasosa, geralmente em virtude da rapidez com que se expande ou se contrai, não troca calor com o meio externo. Neste tipo de transformação nada permanece constante, há mudança na temperatura, pressão e no volume.
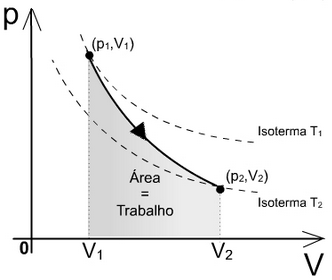
Obs. 1: Em casos de expansão adiabática, ou seja, quando ocorre um aumento de volume e não há troca de calor, tanto a temperatura quanto a pressão diminuem. Este é o caso retratado no gráfico acima.
Obs. 2: Em casos de compressão adiabática, isto é, quando ocorre uma diminuição do volume e não há troca de calor, tanto a temperatura quanto a pressão aumentam. Para percebermos isto, basta invertermos o sentido da transformação do gráfico acima.
Obs. 3: Estudaremos mais detalhadamente esta transformação na aula 6.11, ao discutirmos a primeira lei da termodinâmica