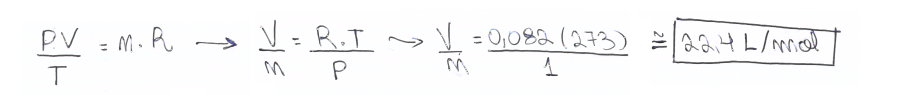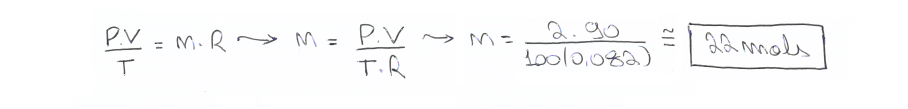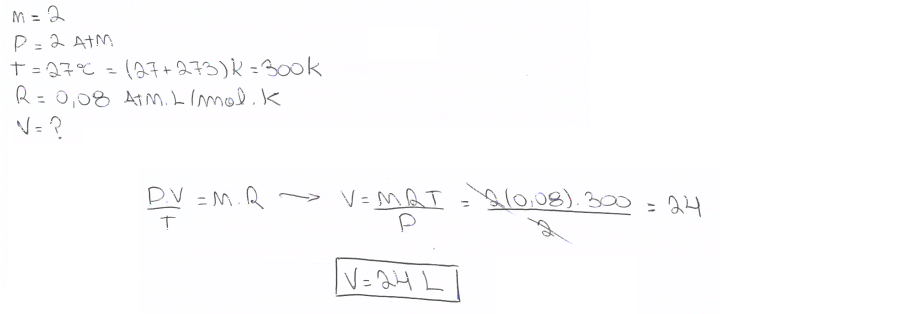Lista
Lista 
Lista 6-46: Leis dos gases ideais (equação de Clapeyron)

01. Determine o volume molar de um gás ideal, cujas condições estejam normais, ou seja, a temperatura à 273K e a pressão a 1 atm. (Dado: R = 0,082 atm.L/mol.K)
02. Determine o número de mols de um gás que ocupa volume de 90 litros. Este gás está a uma pressão de 2 atm e a uma temperatura de 100K. (Dado: R = 0,082 atm.L/mol.K)
03. (PUC-SP) Um certo gás, cuja massa vale 140g, ocupa um volume de 41 litros, sob pressão 2,9 atmosferas a temperatura de 17°C. O número de Avogadro vale 6,02. 1023 e a constante universal dos gases perfeitos R= 0,082 atm.L/mol.K.
Nessas condições, o número de moléculas continuadas no gás é aproximadamente de:
|
a) 3,00.1024. b) 5,00.1023. |
c) 6,02.1023. d) 2,00.1024. |
e) 3,00.1029. |
04. (FPS-PE) Um balão contendo gás hélio está na temperatura ambiente (T = 20 ºC ≈ 293 K) e na pressão atmosférica (P = 1,0 atm ≈ 105 Pascal). O balão contém 2 mols desse gás nobre. Assuma que o gás hélio comporta-se como um gás ideal e que a constante universal dos gases perfeitos vale: R = 8,31 (J/mol.K). Determine o volume aproximado ocupado pelo gás no interior do balão.
|
a) 0,50 m3. b) 5,00 m3. |
c) 2,50 m3. d) 10,00 m3. |
e) 0,05 m3. |
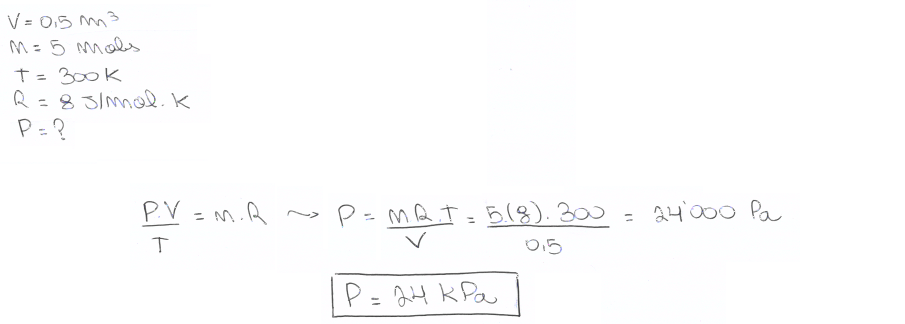
05. Determine a pressão, em Kpa, exercida nas paredes de um recipiente de 0,5 m3, no qual estão confinados 5 mol de um gás perfeito a 27 °C (300 k).
Dado: Considere R = 8 (J/mol.K)
|
a) 12. b) 15. |
c) 20. d) 24. |
e) 26. |
06. Um gás ideal está confinado em um recipiente cúbico de aresta igual a 1 m. A pressão exercida sobre as paredes do recipiente corresponde a 41'500 Pa. Sabendo que a temperatura do gás é de 100 K, determine o número de moléculas contidas no recipiente.
Dado: Considere R = 8,3 (J/mol.K)
|
a) 30 mols. b) 35 mols. |
c) 40 mols. d) 50 mols. |
e) 80 mols. |
07. Dois mols de um gás ideal encontram-se à pressão de 2 atm e temperatura de 27 ºC. Determine o volume ocupado por esse gás.
Dados: R = 0,08 atm.L/mol.K
|
a) 36 L. b) 24 L. |
c) 50 L. d) 48 L. |
08. (Unifesp) Um estudante contou ao seu professor de Física que colocou uma garrafa PET vazia, fechada, no freezer de sua casa. Depois de algum tempo, abriu o freezer e verificou que a garrafa estava amassada. Na primeira versão do estudante, o volume teria se reduzido de apenas 10% do volume inicial; em uma segunda versão, a redução do volume teria sido bem maior, de 50%. Para avaliar a veracidade dessa história, o professor aplicou à situação descrita a Lei Geral dos Gases Perfeitos, fazendo as seguintes hipóteses, que admitiu verdadeiras:
– a garrafa foi bem fechada, à temperatura ambiente de 27°C, e não houve vazamento de ar;
– a temperatura do freezer era de –18°C;
– houve tempo suficiente para o equilíbrio térmico;
– a pressão interna do freezer tem de ser menor do que a pressão ambiente (pressão atmosférica). Assim, o professor pôde concluir que o estudante:
a) falou a verdade na primeira versão, pois só essa redução do volume é compatível com a condição de que a pressão interna do freezer seja menor do que a pressão ambiente.
b) falou a verdade na segunda versão, pois só essa redução do volume é compatível com a condição de que a pressão interna do freezer seja menor do que a pressão ambiente.
c) mentiu nas duas versões, pois ambas implicariam em uma pressão interna do freezer maior do que a pressão ambiente.
d) mentiu nas duas versões, pois é impossível a diminuição do volume da garrafa, qualquer que seja a relação entre a pressão interna do freezer e a pressão ambiente.
e) mentiu nas duas versões, pois nessas condições a garrafa teria estufado ou até mesmo explodido, tendo em vista que a pressão interna do freezer é muito menor do que a pressão ambiente