Aula
Aula 
Aula 6-48: Leis da termodinâmica

Lei zero da termodinâmica
|
É a lei que estabelece a transitividade do equilíbrio térmico. Isto é, de acordo com esta lei, se um corpo A está simultaneamente em equilíbrio térmico com um corpo B e um corpo C, então B e C estão em equilíbrio térmico. |
|
Primeira lei da termodinâmica
Esta lei é uma versão da lei de conservação de energia. Tal lei afirma que o calor cedido a um sistema contendo uma porção gasosa é igual à variação de sua energia interna somada ao trabalho realizado por esta porção de gás.
É comum, também, vermos esta mesma lei expressa do seguinte modo:
➔ OBS. SOBRE A VARIAÇÃO DE ENERGIA INTERNA DO GÁS:
A variação de energia interna do gás ocorrerá sempre que variar a temperatura do gás; pois a variação de energia para gases ideais é função da variação de temperatura:
Misturando-se esta equação com a equação de Clapeyron, obetermos a seguinte relação:
➔ CONVENÇÃO DE SINAIS:
|
Q |
Recebe calor |
Cede calor |
Adiabática |
|
Q > 0 |
Q < 0 |
Q = 0 |
|
|
Δ U |
A temperatura aumenta |
A temperatura diminui |
Isotérmica |
|
Δ U > 0 |
Δ U < 0 |
Δ U = 0 |
|
|
τ |
O volume expande |
O volume comprime |
Isovolumétrica |
|
τ > 0 |
τ < 0 |
τ = 0 |
Trabalho nas transformações adiabáticas
Como sabemos, as transformações adiabáticas são aquelas em que não há troca de calor entre o gás e o meio externo; assim sendo, podemos, a partir da primeira lei da termodinâmica, inferir que:
Segunda lei de termodinâmica
➔ ENTROPIA
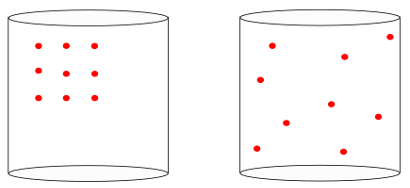
Entropia é uma grandeza física que indica o grau de desordem de um sistema. A imagem abaixo ilustra um recipiente que possui em seu interior gás. Observe que o grau de desordem na segunda imagem é maior que o da primeira, pois, na primeira, as moléculas de gás concentram-se todas em um canto do recipiente, ao passo que, na segunda, elas espalham-se por todo o receptáculo.
➔ ENUNCIADOS DA SEGUNDA LEI: Ao longo da história, muitos cientistas se referiram a segunda lei da termodinâmica de diferentes modos, porém nunca contraditórios. Abaixo estão elencados alguns dos mais notórios enunciados:
I. Enunciado geral:
Num sistema termodinamicamente isolado, a entropia tende sempre a aumentar. Em outras palavras: a variação de entropia sempre será maior que zero ; ou ainda: qualquer processo espontâneo tenderá a sempre aumentar a desordem do sistema
II. Enunciado de Clausius
O calor não pode fluir, espontaneamente, de um corpo de temperatura menor, para um outro corpo de temperatura maior
III. Enunciado de Kelvin-Plank
É impossível a construção de uma máquina que, operando em um ciclo termodinâmico, converta toda a quantidade de calor recebido em trabalho
A segunda lei na prática:
⚛ Ao quebrarmos um frasco de perfume, as moléculas que o constituem e dão odor ao perfume, rapidamente se espalharão pelo ambiente, aumentando o grau de entropia; prova disso é que podemos detectar o odor do perfume assim que o mesmo é quebrado;
⚛ O apodrecimento de produtos orgânicos também depõe a favor da segunda lei; pois ao mantermos um orgânico sem vida isolado num sistema, a entropia do sistema aumentará, fazendo as moléculas do composto orgânico se desintegrarem, dilacerando e dando o caráter horrendo que característico de um produto putrefato;
⚛ O simples esfriar de uma xícara de café quente também é produto da segunda lei da termodinâmica. As moléculas que se concentram agitadas na xícara tenderão a dispersarem energia fazendo a temperatura do café cair;
⚛ Também como consequência desta lei, não há maquina térmica que, operando em ciclos, consiga converter integralmente calor em energia e, portanto, não há moto-perpétuo (veremos isso nas próximas aulas).